肿瘤细胞虽然起源于正常细胞,但由于其独特的生化组成、抗原特征和异常的生物学行为,理论上可以与非恶性细胞区分开来。肿瘤细胞通过伪装机制规避免疫监视。包括:减少对T细胞识别靶细胞抗原至关重要的MHC分子的表达,从而逃避免疫检测;下调肿瘤相关抗原(TAA)的表达,降低其对T细胞的可见性;通过突变产生免疫原性较差的新生抗原(TSA),从而削弱免疫反应的效力;修饰或阻断抗原处理和呈递途径,阻碍免疫细胞的激活。
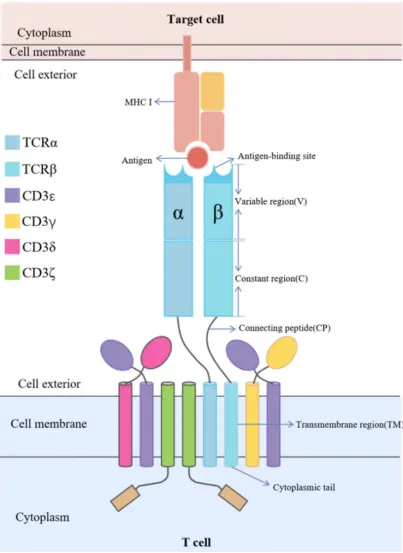
图1. αβ TCR-CD3 复合物的结构示意图
用于治疗实体肿瘤的TCR-T细胞治疗的抗原可分为肿瘤相关抗原(TAA)、肿瘤特异性抗原(TSA)、致癌病毒表达的肿瘤抗原以及由异常蛋白质修饰引起的肿瘤抗原。TAA包括组织分化抗原、癌胚抗原等,每种都有其自身的特点和局限性。TSA是由致癌突变产生的肿瘤所特有的,获取它们的方法包括高分辨率质谱、全外显子组测序等。
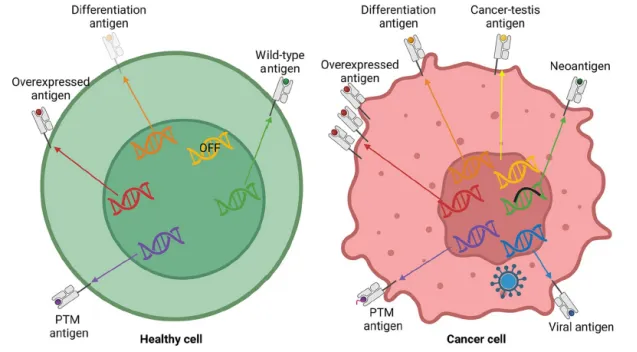
图2. 肿瘤中不同种类的抗原
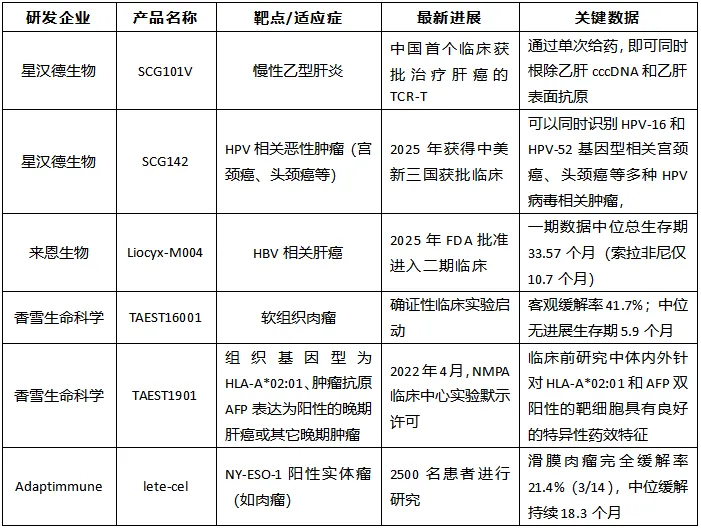
表1. TCR-T最新临床进展与突破性产品
肿瘤微环境( TME)由多样化的细胞和可溶性因子组成,构成了一个复杂的生态系统,是癌症免疫编辑的关键场所。这一特殊环境包含众多免疫抑制因素,对 T 细胞介导的抗肿瘤免疫构成了重大挑战。 免疫抑制环境包括调节性细胞(如 Tregs、 MDSCs 、 TAMs 和 CAFs )、抑制性细胞因子(如 TGF-β 、 IL-10 和 VEGF )、免疫调节代谢物(如乳酸和腺苷),以及不利的低氧条件。
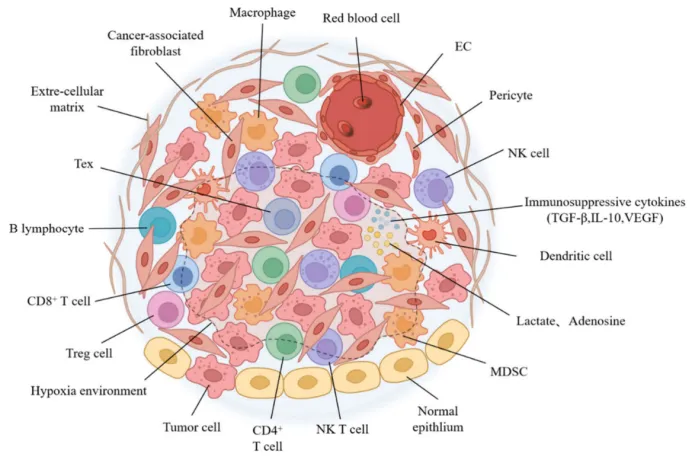
图3. TME及其关键免疫抑制成分示意图
为优化
T细胞介导的免疫疗法,研究人员正在积极开发多种
TME
重编程策略。
这些创新方法包括:
①
靶向小分子抑制剂(包括
IDO
抑制剂、
A2A
受体拮抗剂和
CSF1R
抑制剂),旨在调节
TME
的代谢环境和免疫抑制细胞活性。
②
应用免疫刺激性细胞因子(如
IL-2
、
IL-12
和
IFN-γ
)以增强
T
细胞活化和功能。尽管系统性毒性曾限制其临床应用,但通过开发工程化细胞因子变体(尤其是
IL-2
突变体)和局部递送系统等创新方法,可降低毒性并最大化疗效。
③
使用溶瘤病毒,其能特异性靶向并裂解肿瘤细胞,从而促进肿瘤抗原释放及后续免疫应答的激活。通过与免疫检查点抑制剂(
ICIs)联合使用,进一步增强了治疗效果,提升了
T
细胞浸润和抗肿瘤活性。
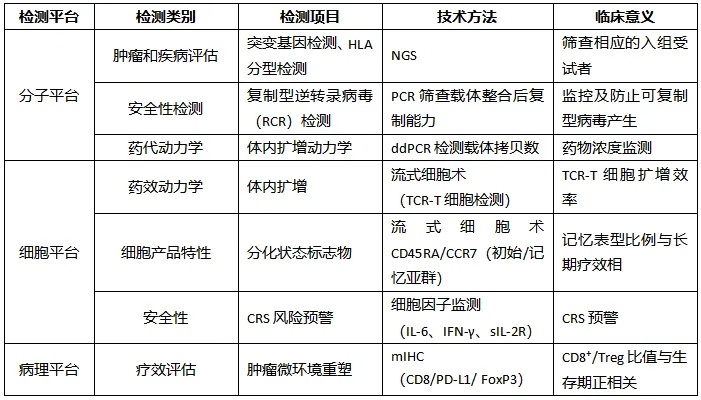
表 2. TCR-T 临床研究核心检测项目与意义
尽管 TCR-T细胞疗法在癌症治疗中展现了显著的疗效。虽然可能引发多种包括 CRS 、神经毒性及其他 免疫相关的不良事件 。但随着对 T细胞生物学理解的加深和筛选技术的进步,基于 T 细胞的免疫疗法为更广泛的患者群体带来持久临床获益的前景日益明朗。
参考文献
[1] Minguet, S.; et al. From TCR fundamental research to innovative chimeric antigen receptor design. Nat. Rev. Immunol 2025, 25 (3), 212−224.