系统性红斑狼疮是一种多系统受累、高度异质性的自身免疫病。2019年欧洲抗风湿病联盟(EULAR)/美国风湿病学会(ACR)联合发布的SLE分类标准(表1)的敏感度为96%,特异性为93%。《系统性红斑狼疮诊疗规范》(2023年)指出:具有两个以上系统受累合并自身免疫证据(如自身抗体阳性、补体降低等)的年轻女性应怀疑 SLE。
表1 2019 年 EULAR/ACR 制定的 SLE 分类标准

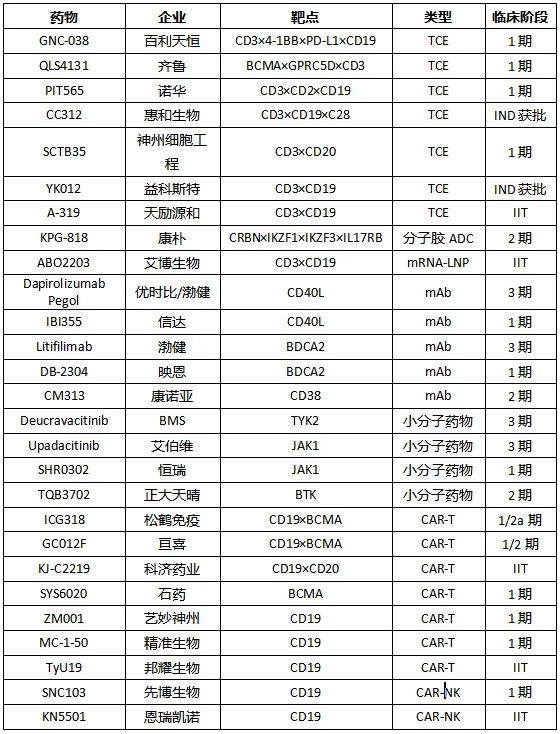
表2 针对 SLE适应症的部分代表性管线
B细胞功能亚群分析在靶向
B
细胞的细胞治疗产品、抗体类药物中应用广泛,可检测
CD45
、
CD19
、
CD20
、
CD21
、
CD27
、
IgD
、
CD38
等指标,分析初始
B
细胞(
Naïve B
)、记忆
B
细胞(
Memory B
)、浆细胞(
Plasma
)等
B
细胞亚群,检测在
SLE
患者中的变化。
靶向 T细胞治疗及 T 细胞功能亚群评估对 SLE 临床检测有重要意义,可检测 CD4+ 、 CD8+ T 细胞的比例及活化状态等。例如,调节性 T 细胞的功能异常与 SLE 的发病相关。
4.2 补体C3/C4
检测
在
2019年
EULAR/ACR
制定的
SLE
分类标准中,免疫学指标:补体
C3
或
C4
降低的权重评分为
3
分,补体
C3
和
C4
降低的权重评分为
4
分。
研究显示: ANA阳性伴 C3 或 C4 单项降低时对 SLE 诊断的特异性为 94.3% ,而 ANA 阳性伴 C3 与 C4 同时降低时特异性可达 97.6% 。此外, C3和 C4 水平下降可先于临床症状出现,并与 SLE 疾病活动度呈正相关 ,尤其在合并肾脏或血液系统受累的 SLE患者中更为显著 。但鉴于 C3和 C4 对 SLE 诊断的特异性较低,若单独使用,其作为生物标志物在 SLE 诊断和疾病活动度评估中的可靠性可能受限 。
4.3 细胞因子检测
自身免疫性疾病主要表现为组织器官的炎症性损伤,特别是 IL-1β、 IL-2 、 IL-6 、 IL-8 、 IL-10 、 IL-12 、 IL-17 、 IL-18 、 IFN-γ, TNF-α 等细胞因子是调控自身免疫疾病患者病理损伤过程的关键因素,检测患者促炎 / 抗炎性细胞因子随疾病进展的变化趋势,可评估患者炎症性损伤发展情况及预后。
4.4 I 型干扰素基因表达检测
4.4.1 21-基因
IFNGS
检测
Sifalimumab(西伐木单抗)是一种人源性抗
IFN-α
抗体,
II
期临床证实其对
SLE
患者安全有效。研究人员开发了一套
I
型干扰素基因
mRNA
组合(
21-基因Panel,IFI27、IFI6、RSAD2、IFI44、IFI44L、USP18、LY6E、OAS1、SIGLEC1、ISG15、IFIT1、OAS3、HERC5、MX1、LAMP3、EPSTI1、IFIT3、OAS2、RTP4、PLSCR1、DNAPTP6 ),作为
Sifalimumab治疗
SLE
的潜在药效学(
PD
)标志物。
4.4.2 4-基因
IFNGS
检测
Anifrolumab(阿伏利尤单抗)是全球首个获批的靶向
I
型干扰素通路的生物制剂。该药物于
2021
年
8
月在美国获批上市,用于治疗中重度系统性红斑狼疮(
SLE
)成人患者。
2022
年
12
月,
Anifrolumab
在中国香港地区成功获批。此外,得益于
“
港澳药械通
”
政策,
Anifrolumab
于
2024
年正式获得广东省药品监督管理局批准,被引进粤港澳大湾区药械通指定医疗机构,成为
SLE
患者的治疗新选择。
研究人员对中重度 SLE患者静脉注射 Anifrolumab 的 52 周 III 期 TULIP-1/TULIP-2 安慰剂对照试验的汇总数据进行了事后分析。采用 PCR检测技术 测定 IFN gene signature( IFNGS ) —— 基于4个基因(IFI27、IFI44、IFI44L、RSAD2) 的表达值,根据 双峰分布的低谷处预设的ΔCt阈值区分基线时具有IFNGS-high与 IFNGS-low的患者 。患者接受了 Anifrolumab 300 mg (360/726) 或安慰剂 (366/726) ; 82.6% 是 IFNGS 高的,与 IFNGS 低的患者相比, IFNGS 高的患者具有更大的基线疾病活动性。在总人群中,接受 Anifrolumab 治疗的患者与安慰剂相比,更大比例的患者在第 52 周达到了 BICLA 反应( 差异 16.6%,p<0.001 )。
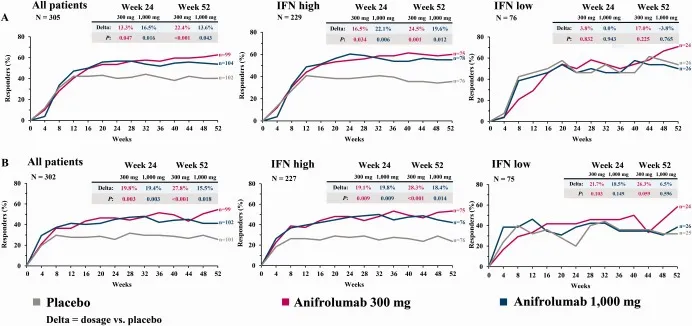
图1 SLE患者随时间推移的疗效结果:接受
Anifrolumab 300 mg
、
Anifrolumab 1000 mg
或安慰剂治疗
基于多平台协同整合的技术优势,迈杰医学( MEDx)提供了 SLE 研究的全面检测体系:
分子中心 : 借助 PCR和 NGS 平台开展深度分子层面的检测。基因表达检测中, qPCR 技术可以对 IFI27 、 IFI44 等 I 型干扰素相关基因进行精准的定量, NGS 转录组测序一次可检测数万个基因,全景式解析患者基因表达变化图谱,适用于早期探索性研究;细胞治疗产品 VCN 检测中,采用荧光定量 PCR 或数字 PCR 方法实现对外周血样本、骨髓样本、新鲜组织样本、 FFPE 样本、肿瘤穿刺样本等多种样本类型的 CAR-T 拷贝数检测;整合位点安全性评估依托二代测序与生物信息学分析,精准定位病毒载体整合位点,为细胞治疗长期安全性评估提供可靠依据; HLA 基因分型利用高分辨率测序技术,精确区分多个位点等位基因,为 SLE 遗传易感性研究与免疫治疗精准匹配开辟新路径; TCR/BCR 免疫组库分析通过高通量测序,深度挖掘 T 、 B 细胞受体多样性,为创新免疫治疗策略研发提供关键线索。
病理中心: 免疫组化( IHC)和荧光原位杂交( FISH )技术在 SLE 药物开发中具有重要意义。 IHC 技术可以对 SLE 患者病变组织中的细胞类型、细胞表面标志物以及细胞内信号通路相关蛋白进行精确定位和定量分析。例如,通过 IHC 检测组织中 B 细胞、 T 细胞亚群的分布以及细胞因子受体的表达水平,有助于揭示 SLE 免疫细胞异常浸润和激活的特征,为靶向免疫细胞治疗药物的开发提供依据。 FISH 技术则能够检测 SLE 患者细胞中基因的扩增、缺失或重排等异常情况。在 SLE 发病过程中,某些基因的异常表达可能与疾病的易感性或严重程度相关。通过 FISH 技术可以精准定位这些基因的改变,为开发基于基因靶点的药物提供关键信息。例如,如果发现某一基因的扩增与 SLE 疾病活动性密切相关,那么针对该基因产物的抑制剂就可能成为潜在的治疗药物。同时, FISH 技术还可用于检测药物对基因表达的影响,评估药物的疗效和安全性。
流式平台: 鉴于 B细胞在 SLE 发病机制中的重要作用,近年来开发出许多靶向 B 细胞治疗 SLE 的方法。靶向 B 细胞的治疗策略包括直接杀伤 B 细胞、调节 B 细胞功能、抑制 B 细胞生长和存活必需的分子、加速自身抗体清除等 。 外周血 B细胞及浆细胞亚群的早期变化可作为 SLE 复发的预测指标 。
表3 流式检测方案展示
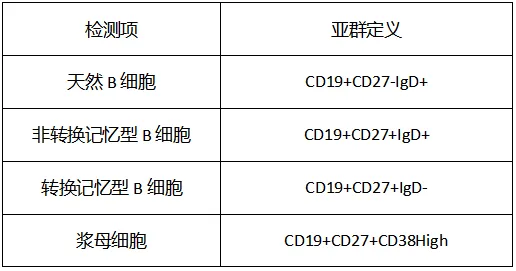
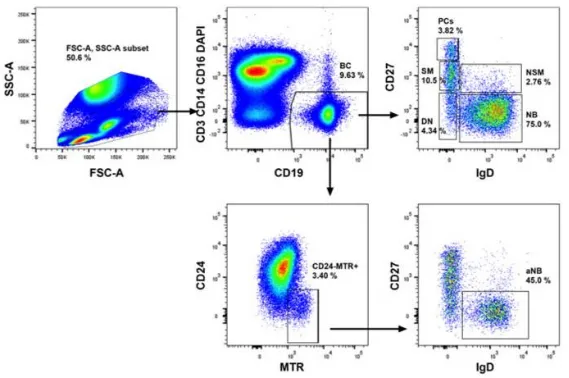
图2 流式 图 展示
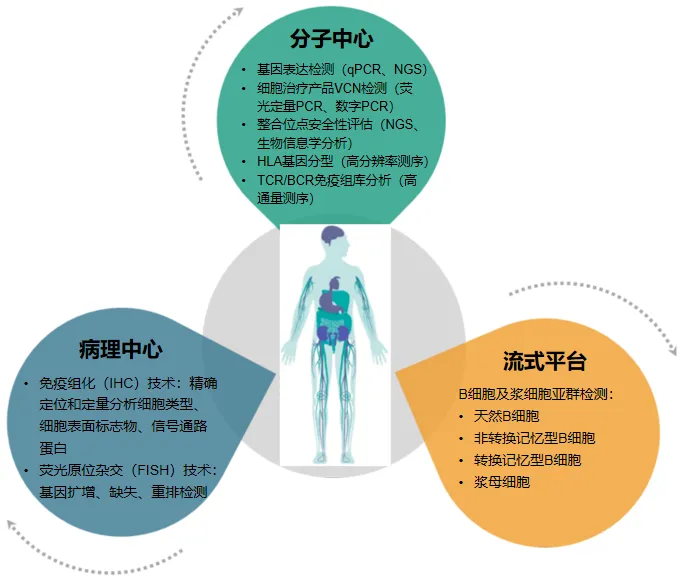
图3 SLE整体解决方案
参考文献
[1].田新平
, 李梦涛
, and
曾小峰
. "
从我国系统性红斑狼疮的诊治现状寻找可能的解决方案
——
来自《 中国系统性红斑狼疮发展报告
2020
》 的启示
."
协和医学杂志 13.2 (2022): 169-173.
[2].Tedeschi, Sara K., et al. "Multicriteria decision analysis process to develop new classification criteria for systemic lupus erythematosus." Annals of the rheumatic diseases 78.5 (2019): 634-640.
[3].沈南
, 赵毅
, and
段利华
. "
系统性红斑狼疮诊疗规范
."
中华内科杂志 62.7 (2023): 775-784.
[4].Li, Hejun, et al. "Diagnostic value of serum complement C3 and C4 levels in Chinese patients with systemic lupus erythematosus." Clinical rheumatology 34 (2015): 471-477.
[5].Petri, Michelle A., et al. "Baseline predictors of systemic lupus erythematosus flares: data from the combined placebo groups in the phase III belimumab trials." Arthritis & Rheumatism 65.8 (2013): 2143-2153.
[6].Ho, Audrey, et al. "A decrease in complement is associated with increased renal and hematologic activity in patients with systemic lupus erythematosus." Arthritis & Rheumatism 44.10 (2001): 2350-2357.
[7].Larosa, Maddalena, et al. "Advances in the diagnosis and classification of systemic lupus erythematosus." Expert review of clinical immunology 12.12 (2016): 1309-1320.
[8].Yao, Yihong, et al. "Development of potential pharmacodynamic and diagnostic markers for anti-IFN-α monoclonal antibody trials in systemic lupus erythematosus." Human genomics and proteomics: HGP 2009 (2009): 374312.
[9].Yao, Yihong, et al. "Use of type I interferon-inducible mRNAs as pharmacodynamic markers and potential diagnostic markers in trials with sifalimumab, an anti-IFNα antibody, in systemic lupus erythematosus." Arthritis research & therapy 12 (2010): 1-7.
[10].Furie, Richard, et al. "Anifrolumab, an anti–interferon‐α receptor monoclonal antibody, in moderate‐to‐severe systemic lupus erythematosus." Arthritis & rheumatology 69.2 (2017): 376-386.
[11].Vital, Edward M., et al. "Anifrolumab efficacy and safety by type I interferon gene signature and clinical subgroups in patients with SLE: post hoc analysis of pooled data from two phase III trials." Annals of the rheumatic diseases 81.7 (2022): 951-961.