继曲妥珠单抗取得成功后,此后多种抗HER-2 治疗药物,以德曲妥珠单抗(T-DXd
, DS-8201 )和RC48
为代表的新型ADC
药物有望破解治疗困局,由于独特的作用机制,其可部分克服传统抗HER-2
药物的耐药机制,如旁路激活等问题[5]。此外,由于
“旁观者效应
” ,
ADC也为部分
HER-2低表达胃癌患者带来了治疗突破,扩大了治疗获益人群。
T-DXd作为新一代
HER-2 ADC,已经在
DESTINY-Gastric01(
DG-01)
和DG-06 研究中展现了其在胃癌后线治疗领域的卓越疗效,基于中国胃癌患者的DG-06
桥接试验同样显示,T-DXd
带来了具有临床意义且持久的缓解,且安全性可控,中位OS
时间达11
个月[6],为患者带来新的标准治疗选择。其在
HER-2阳性晚期胃癌
/GEJC一线治疗中的
Ⅰb/ Ⅱ期临床研究
DG-03结果也在
2024年
ESMO年会上公布,结果显示,在全人群中,
T-DXd组的
ORR为
49%,中位
OS 时间达
18 个月,与标准治疗方案相当。
T-DXd +化疗组在全人群里中的
ORR 达
78% ,中位
OS 时间达
23 个月,为
6 个治疗组中最高。在
PD-L1 CPS≥1 人群中,
T-DXd 联合帕博利珠单抗组的中位
OS 时间也达到
23 个月,颇具潜力。
T-DXd 首次在
HER-2 阳性胃癌一线治疗的实践引人关注,未来对于
PD-L1 CPS≥1 的
HER-2 阳性患者,进一步优化
T-DXd 联合帕博利珠单抗及化疗的剂量及给药方案,以平衡其疗效和安全性,将成为研究重点。
RC48已在局部晚期或转移性胃癌患者,包括 HER-2低表达人群的后线治疗中取得较好疗效。 RCTS研究将 RC48的使用进一步前移,评估其联合替雷利珠单抗和 S-1用于 HER-2过表达的进展期胃癌或 GEJC一线治疗的疗效和安全性[7] 。三药联合方案取得了94.3% 的ORR ,即使是在HER-2 低表达或PD-L1 低表达患者中也达到了>80% 的ORR[8] ,且安全性可控,展现了优异的近期疗效,填补了HER-2 IHC 2+ FISH- 人群精准治疗的空白。


图 1 GLOW研究
研究表明,20% ~30% 的胃癌患者存在FGFR2b 过表达,且与患者的预后不良和治疗耐药有关[14-15]。 FIGHT研究评估了 Bemarituzumab 这一靶向 FGFR2b 的单克隆抗体联合 mFOLFOX6 对比单纯化疗一线治疗 HER-2 阴性及 FGFR2b 过表达晚期胃癌患者的疗效,结果显示联合治疗组中位 PFS 时间( 9.5 个月 ∶ 7.4 个月, HR = 0.72 , 95%CI 为 0.49 ~ 1.08 )及中位 OS 时间( 19.2 个月 ∶ 13.5个月, HR = 0.77 , 95%CI 为 0.52 ~ 1.14 )有延长趋势。东亚人群亚组分析显示获益更佳,中位 PFS 时间和中位 OS 时间分别达 12.9 个月( HR = 0.50 , 95%CI 为 0.29 ~ 0.87 )和 24.7 个月( HR = 0.56 , 95%CI 为 0.32 ~ 0.96 ),东亚人群 FGFR2b 高表达组中,联合治疗使得中位 OS 时间达到 30.1 个月( HR = 0.43 , 95%CI 为 0.22 ~ 0.86 ),刷新了胃癌一线治疗的生存纪录[16] 。目前全球多中心 Ⅲ 期随机对照研究已入组完成,期待后续研究结果公布,有望进一步丰富胃癌精准靶向治疗方案。

图 2 2025年 CSCO 胃癌诊疗指南
2025 CSCO指南会于
4
月
18
至
19
日在泉城济南隆重召开。在大会首日的胃癌专场,
2025年版《CSCO胃癌诊疗指南》更新要点发布 。
值得关注的是,针对FGFR2b的检测已经作为2B类的证据被纳入病理检测关于分子标志物检测的三级推荐;CLDN18.2的检测也由原来的二级推荐升至一级推荐,标志着胃癌精准诊疗领域又迈出了重要一步。
从
KEYNOTE-585和
ATTRACTION-5
研究
,我们发现这两项研究均
未能达到主要研究终点,
但亚组分析显示PD-L1高表达、MSI-H等患者生存获益明显,提示对于胃癌这一异质性较强的瘤种,在试验设计之初就必须考虑选择治疗优势人群,制订分层治疗策略。 免疫治疗奠定晚期胃癌一线治疗地位后,继续向围手术期推进,多项研究证实了其近期缩瘤降期效能,
但精准筛选人群、改善长期生存获益的探索之路任重道远 。新型靶向
HER-2 ADC药物从后线稳步向前推进,整体重塑胃癌治疗格局,且其扩大了治疗获益人群,有望改写传统的
HER-2
状态分类定义。针对
CLDN18.2
、
FGFR2b
等靶点的精准治疗进展进一步丰富了治疗方案选择。
未来,这些药物如何与既有疗法,特别是免疫治疗的联用,如何优化治疗策略,最大程度地提升疗效,将成为研究热点。 “ 精准 ” 是未来胃癌治疗的必然方向,这离不开患者在治疗前对相应生物标志物( PD-L1 , HER-2 , Claudin18.2 , FGFR2b 等)的检测,从而精准地筛选出获益人群,显著改善胃癌患者的生存获益。

图 3 胃癌患者多靶点共表达情况
目前,迈杰转化医学研究(苏州)有限公司自主选择的PD-L1、HER-2、Claudin18.2和FGFR2b等特异性单克隆抗体,已证实可用于FFPE组织样本的IHC染色,在胃癌等组织上有良好的染色性能。迈杰医学针对这些靶点的抗体试剂(免疫组织化学法)已在Leica等全自动染色平台上完成技术可行性研究,建立各个靶点IHC检测的方法学,并依托中心实验室参与支持国内外多家申办方的早期及关键临床试验的多癌种样本检测。
与此同时,迈杰医学的PD-L1抗体(E1L3N和JS311)伴随诊断试剂盒已获得国家III类证获批,在《乳腺癌免疫治疗临床应用专家共识》(2024版)中,首次推荐三阴性乳腺癌患者使用JS311抗体进行PD-L1的检测,指导患者免疫治疗。Claudin18.2和FGFR2b也获得了I类获批,致力于为精准医疗领域提供高质量的诊断解决方案。
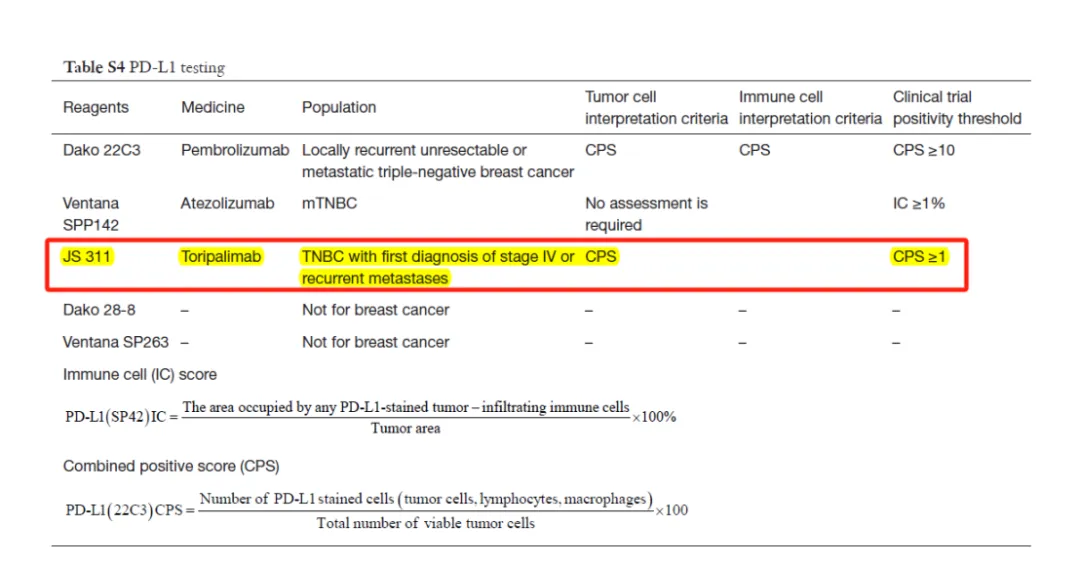
图 4 《乳腺癌免疫治疗临床应用专家共识》推荐使用 JS311 进行 PD-L1 检测
参考文献
[1] 郑荣寿
,
张思维
,
孙可欣
,
等
. 2016
年中国恶性肿瘤流行情况分析
[J] .
中华肿瘤杂志
, 2023, 45(3) : 212-220. DOI:10.3760/cma.j.cn112152-20220922-00647.
[2] SHITARA K, RHA S Y, WYRWICZ L S, et al. Neoadjuvant and adjuvant pembrolizumab plus chemotherapy in locally advanced gastric or gastro-oesophageal cancer (KEYNOTE-585): an interim analysis of the multicentre, double-blind, randomised phase 3 study[J]. Lancet Oncol, 2024, 25(2):212-224.
[3] SHITARA K, RHA S Y, WYRWICZ L S, et al. LBA3 Final analysis of the phase Ⅲ
KEYNOTE-585 study of pembrolizumab plus chemotherapy vs chemotherapy as perioperative therapy in locally-advanced gastric and gastroesophageal junction cancer[J]. Ann Oncol, 2024, 35(Suppl 1):S213.
[4] KANG Y K, TERASHIMA M, KIM Y W, et al. Adjuvant nivolumab plus chemotherapy versus placebo plus chemotherapy for stage
Ⅲ
gastric or gastro-oesophageal junction cancer after gastrectomy with D2 or more extensive lymph-node dissection (ATTRACTION-5): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Gastroenterol Hepatol, 2024, 9(8):705-717.
[5] LI Z, ZHAO H, HU H, et al. Mechanisms of resistance to trastuzumab in HER2-positive gastric cancer[J]. Chin J Cancer Res, 2024, 36(3):306-321.
[6] SHEN L, CHEN P, LU J, et al. Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2-positive (HER2
+
) advanced gastric or gastroesophageal junction adenocarcinoma (GEJA): DESTINY-Gastric06 (DG-06) final analysis[J]. Ann Oncol, 35(Suppl 4), S1454-S1455.
[7] LI S, LIU Z, LIU Y, et al. Efficacy of disitamab vedotin (RC48) plus tislelizumab and S-1 as first-line therapy for HER2-overexpressing advanced stomach or gastroesophageal junction adenocarcinoma: a multicenter, single-arm, phase
Ⅱ
trial (RCTS)[J]. J Clin Oncol, 2024, 42(Suppl 16):4009.
[8] TSUCHIKAMA K, ANAMI Y, HA S Y Y, et al. Exploring the next generation of antibody-drug conjugates[J]. Nat Rev Clin Oncol, 2024, 21(3):203-223.
[9] TÜRECI O, KOSLOWSKI M, HELFTENBEIN G, et al. Claudin-18 gene structure, regulation, and expression is evolutionary conserved in mammals[J]. Gene, 2011, 481(2):83-92.
[10] QI C, CHONG X, ZHOU T, et al. Clinicopathological significance and immunotherapeutic outcome of claudin 18.2 expression in advanced gastric cancer: a retrospective study[J]. Chin J Cancer Res, 2024, 36(1):78-89.
[11] KUBOTA Y, KAWAZOE A, MISHIMA S, et al. Comprehensive clinical and molecular characterization of claudin 18.2 expression in advanced gastric or gastroesophageal junction cancer[J]. ESMO Open, 2023, 8(1):100762.
[12] SHAH M A, SHITARA K, AJANI J A, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial[J]. Nat Med, 2023, 29(8):2133-2141.
[13] SHITARA K, LORDICK F, BANG Y J, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial[J]. Lancet, 2023, 401(10389):1655-1668.
[14] KATOH M, NAKAYAMA I, WAINBERG Z A, et al. Monoclonal antibodies that target fibroblast growth factor receptor 2 isoform b and Claudin-18 isoform 2 splicing variants in gastric cancer and other solid tumours[J]. Clin Transl Med, 2024, 14(6):e1736.
[15] TURNER N, GROSE R. Fibroblast growth factor signalling: from development to cancer[J]. Nat Rev Cancer, 2010, 10(2):116-129.
[16] KANG Y K, QIN S, LEE K W, et al. Bemarituzumab plus mFOLFOX6 as first-line treatment in East Asian patients with FGFR2b-overexpressing locally advanced or metastatic gastric/gastroesophageal junction cancer: subgroup of FIGHT final analysis[J]. Gastric Cancer, 2024, 27(5):1046-1057.